Taktyka leczenia operacyjnego raka tarczycy w oddziale chirurgicznym
Streszczenie
Cel pracy:
Celem niniejszej pracy jest analiza klinicznego materiału operacji raka tarczycy, zgromadzonego w latach 1994-2003 w Oddziale Chirurgicznym Okręgowego Szpitala Kolejowego w Gdańsku, gdzie w tym okresie opierano się na standardzie radykalnego postępowania operacyjnego, przyjętego oficjalnie na Konferencji „Rak tarczycy”.
Materiał:
W latach 1994-2003 w Oddziale operowano 2111 chorych (K: 1619, M: 493) z powodu rozmaitych schorzeń tarczycy (m.in. wole wieloguzkowe obojętne / nadczynne, guz tarczycy, wole Grave-Basedowa, rak tarczycy).
Metoda:
Operacje przeprowadzano w znieczuleniu ogólnym, z dostępu Kochera (cięcie łukowate 2 palce na wcięciem mostka pomiędzy przednimi brzegami mięśnia mostkowo-obojczykowo-sutkowatego). Od 1993 roku w Oddziale przyjęto regułę zakresu operacji zgodnych ze standardem postępowania: 1). w przypadku wola wieloguzkowego wykonywano całkowite wycięcie płata (zmienionego w większym stopniu) z cieśnią gruczołu, oraz subtotalną resekcję płata przeciwnego; 2). w przypadku pojedynczego guza wykonywano lobektomię z cieśnią; 3). chorzy z rozpoznaniem procesu neoplazmatycznego poddawani byli tyreoidektomii i wycięciu węzłów chłonnych przedtchawiczych; 4). w przypadku podejrzenia klinicznego, lub niejasnego BAC wykonywano badanie doraźne.
Wyniki:
W analizowanym przedziale czasowym zaobserwowano wzrost liczby chorych operowanych z powodu raka tarczycy. Spośród operowanych 19 osób (20%) miało uprzednio wykonaną biopsję cienkoigłową tarczycy. Zaledwie w 1 przypadku wynik biopsji był negatywny, oraz w 1 przypadku histopatolog opisał wynik jako obraz niejasny. Pierwotnie radykalne zabiegi uzyskano w 63 przypadkach (66%) – oceniane na podstawie badania histopatologicznego, a następnie weryfikacji sonograficznej i radioizotopowej. U pozostałych chorych raka tarczycy rozpoznawano dopiero w preparacie operacyjnym; dokonywano radykalizacji w okresie 6-12 tygodni od zabiegu pierwotnego. Należy podkreślić, że stosowanie reguły radykalnego wycięcia po jednej stronie w przypadku braku rozpoznania przedoperacyjnego oraz równocześnie starannego zaopatrzenia kikuta (podwiązywanie gałęzi naczyniowych a nie podkłuwanie gruczołu) po stronie przeciwnej pozwalało na zachowanie dość dobrych warunków anatomicznych w razie ponownej interwencji.
Wstęp
Rak tarczycy stanowi 90% wszystkich nowotworów złośliwych układu endokrynnego. Jednocześnie jego udział w epidemiologii wszystkich chorób nowotworowych nie przekracza 1%. Niemniej jednak rocznie w Polsce odnotowuje się ponad 1000 nowych zachorowań na raka tarczycy; kobiety zapadają około 3 razy częściej na ten nowotwór niż mężczyźni. Populacja chorych w Polsce jest duża i obejmuje około 10 000 pacjentów. Tak duża liczba chorych wynika z dość dobrej skuteczności metod leczniczych oraz ze względnie niskiej agresywności biologicznej raka tarczycy. Z analiz obejmujących duże liczebnie próby wynika, że 10 letnie przeżycia obejmują ponad 85% [1,2].
Właściwe leczenie raka tarczycy obejmuje obok postępowania chirurgicznego także leczenie jodem promieniotwórczym oraz farmakoterapię. Szczegóły takiego postępowania oraz odpowiedniego toku diagnostyki znalazły wyraz w sformułowanych w 1995 roku rekomendacjach wielodyscyplinarnej konferencji – Rak Tarczycy, uaktualnionych w roku 2000 [3,4]. Pomimo ustanowienia tych rekomendacji nadal w Polsce w około połowie przypadków raka tarczycy rozpoznanie uzyskuje się na podstawie badania preparatu operacyjnego [5], więc standard rozpoznania, uzgodniony przez ekspertów często jest nie spełniany, choć wartość diagnostyczna badania cytologicznego jest powszechnie uznana [6]. Leczenie chirurgiczne pozostaje głównym etapem postępowania w przypadku raka tarczycy. Obowiązującym zabiegiem jest całkowite pozatorebkowe wycięcie tarczycy wraz z węzłami chłonnymi okołotarczycowymi, przedkrtaniowymi, przed- i okołotchawiczymi w przypadku postawienia rozpoznania przedoperacyjnego.
W razie braku wyniku biopsji cienkoigłowej, bądź w przypadku wyniku niejednoznacznego w ocenie patologa, konieczne jest aby chirurg zachował dużą dozę czujności. Dotyczy to także przypadku tzw. tumor folliculare, czyli nierozstrzygniętego cytologicznie nowotworu pęcherzykowego. W tym miejscu konieczne jest leczenie radykalne chirurgiczne z wykonaniem badania doraźnego (lobektomia z cieśnią tarczycy i subtotalnym wycięciem płata przeciwnego), gdyż u tych chorych raka rozpoznaje się u nawet 1/3 przypadków [7].
Celem niniejszej pracy jest analiza klinicznego materiału operacji raka tarczycy, zgromadzonego w latach 1994-2003 w Oddziale Chirurgicznym Okręgowego Szpitala Kolejowego w Gdańsku, gdzie w tym okresie opierano się na standardzie radykalnego postępowania operacyjnego, przyjętego oficjalnie na Konferencji „Rak tarczycy”.
Materiał
W latach 1994-2003 w Oddziale operowano 2111 chorych (K: 1619, M: 493) z powodu rozmaitych schorzeń tarczycy (m.in. wole wieloguzkowe obojętne / nadczynne, guz tarczycy, wole Graves-Basedowa, rak tarczycy) (Ryc. 1,2). Pacjentów dobierano losowo – byli kierowani z różnych ośrodków (zarówno specjalistycznych jaki i rejonowych), bądź sami wybierali Oddział jako miejsce zabiegu. Wśród tych pacjentów było 95 (4,5%) osób z rakiem tarczycy (63 kobiet i 32 mężczyzn), w wieku 16-86 lat (średnia wieku: 56±4.5 lat). Pacjentów o gorszym rokowaniu (wiek) było : kobiet w wieku powyżej 50 lat – 63%, natomiast mężczyzn powyżej 40 roku życia – 55%.
U każdej osoby obok badania klinicznego i badań laboratoryjnych (TSH, fT4), wykonywano badanie USG tarczycy. Wszyscy operowani byli w stanie eutyreozy. Liczba pacjentów, u których wykonano diagnostykę cytologiczną (biopsję aspiracyjną cienkoigłową, BAC) przed zabiegiem wynosiła 19 (20%). Wśród tych osób rozpoznanie było trafne w 17 przypadkach.
 Ryc. 1
Ryc. 1
 Ryc. 2
Ryc. 2
Metoda
Pacjenci byli szczegółowo informowani przed zabiegiem o planowanym leczeniu i możliwościach wystąpienia powikłań. Następnie po wyjaśnieniu wątpliwości podpisywali świadomą zgodę na zabieg. Operacje przeprowadzano w znieczuleniu ogólnym, z dostępu Kochera (cięcie łukowate 2 palce na wcięciem mostka pomiędzy przednimi brzegami mięśnia mostkowo-obojczykowo-sutkowatego). Od 1993 roku w Oddziale przyjęto regułę zakresu operacji zgodnych ze standardem postępowania:
1) w przypadku wola wieloguzkowego wykonywano całkowite wycięcie płata (zmienionego w większym stopniu) z cieśnią gruczołu, oraz subtotalną resekcję płata przeciwnego;
2) w przypadku pojedynczego guza wykonywano lobektomię z cieśnią.
3) chorzy z rozpoznaniem procesu neoplazmatycznego poddawani byli tyreoidektomii i wycięciu węzłów chłonnych przedtchawiczych.
4) w przypadku podejrzenia klinicznego, lub niejasnego BAC wykonywano badanie doraźne.
Podczas zabiegu przestrzegano podwiązywania gałęzi tętnic tarczowych na torebce gruczołu, oraz starannego uwidocznienia nerwów krtaniowych wstecznych, bez ich preparowania na dłuższym odcinku. Każdorazowo dokonywano wycięcia węzłów chłonnych przytchawiczych i przedtchawiczych. Doszczętność wycięcia oparta była na makroskopowej ocenie śródoperacyjnej.
Wszystkie preparaty były badane przez histopatologów w jednej pracowni. Badań śródoperacyjnych nie wykonywano rutynowo – jedynie w przypadkach podejrzanych klinicznie, bądź w razie sugestii pochodzących z biopsji cienkoigłowej (BAC).
Limfadenektomii układu chłonnego trójkąta bocznego szyi dokonywano selektywnie w oparciu o obraz kliniczny (powiększone węzły chłonne szyi), bądź obecność zmian patologicznych w badaniu obrazowym, zweryfikowanym pozytywnie BAC bądź śródoperacyjnie.
Radykalizacji dokonywano w okresie 6-12 tygodni od operacji. W trakcie tyreoidektomii uzupełniającej dokonywano obok resekcji pozostałego miąższu gruczołu, także wycięcia węzłów chłonnych grupy przedniej szyi. U pacjentów z rozpoznanym mikrorakiem (śr. guza < 1cm) brodawkowatym nie poszerzano zakresu zabiegu pierwotnego, jeżeli guz znajdował się w płacie wyciętym w całości.
Wyniki
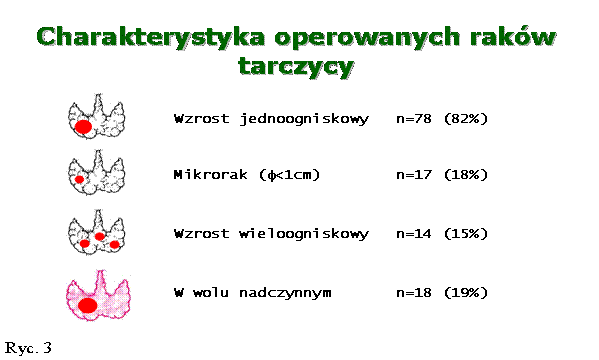
W badanym materiale stwierdzono 81 raków brodawkowatych (85%), 9 raków pęcherzykowych (9%), 3 raki anaplastyczne (3%), 2 raki rdzeniaste (2%), 1 chłoniaka pierwotnego tarczycy (1%). Wzrost jednoogniskowy stwierdzono u 78 pacjentów (82%), przy czym u 17 osób ognisko nie przekraczało średnicy 1 cm (18% ogółu operowanych); u pozostałych 14 osób (15%) zaobserwowano wzrost wieloogniskowy – w 7 przypadkach w obu płatach. Należy podkreślić, że 18 pacjentów (19%) leczyło się wcześniej z powodu nadczynności tarczycy, w tym dwa raki znaleziono w wolu Graves-Basedowa (Ryc. 3).
W analizowanym przedziale czasowym zaobserwowano wzrost liczby chorych operowanych z powodu raka tarczycy, podobnie do trendu w innych badanych populacjach [5,8].
Spośród operowanych 19 osób (20%) miało uprzednio wykonaną biopsję cienkoigłową tarczycy. Zaledwie w 1 przypadku wynik biopsji był negatywny, oraz w 1 przypadku histopatolog opisał wynik jako obraz niejasny.
 Ryc. 3
Ryc. 3
Pierwotnie radykalne zabiegi uzyskano w 63 przypadkach (66%) – oceniane na podstawie badania histopatologicznego, a następnie weryfikacji sonograficznej i radioizotopowej. U pozostałych chorych raka tarczycy rozpoznawano dopiero w preparacie operacyjnym; dokonywano radykalizacji w okresie 6-12 tygodni od zabiegu pierwotnego. Należy podkreślić, że stosowanie reguły radykalnego wycięcia po jednej stronie w przypadku braku rozpoznania przedoperacyjnego oraz równocześnie starannego zaopatrzenia kikuta (podwiązywanie gałęzi naczyniowych a nie podkłuwanie gruczołu) po stronie przeciwnej pozwalało na zachowanie dość dobrych warunków anatomicznych w razie ponownej interwencji.
U 23 operowanych (24%) wykonano badanie śródoperacyjne, wszystkie wyniki były zgodne z preparatami ocenianymi w trybie zwykłym.
W kolejnych latach obserwowano rosnącą liczbę osób operowanych z powodu raka tarczycy (Tabela 1), głównie pod postacią raka brodawkowatego.
| Rak brodawkowaty / pęcherzykowy | Liczba raków | |
|---|---|---|
| 1994 | 5/4 | 9 |
| 1995 | 5/- | 5 |
| 1996 | 4/1 | 5 |
| 1997 | 6/- | 6 |
| 1998 | 6/1 | 8 |
| 1999 | 8/- | 11 |
| 2000 | 10/1 | 11 |
| 2001 | 11/1 | 12 |
| 2002 | 19/- | 20 |
| 2003 | 6/1 | 8 |
Wśród powikłań, trwałe uszkodzenie nerwu krtaniowego wstecznego (utrzymujące się ponad 6 m-cy) stwierdzono w 3 przypadkach, w tym u 1 chorej z rakiem naciekającym tchawicę, u której wykonano tracheostomię po tyreoidektomii. Nie obserwowano objawów trwałej hypoparatyreozy. W 5 przypadkach z uwagi na krwawienie z loży po wyciętym gruczole konieczna była rewizja rany i wykonanie hemostazy.
W kolejnych latach objętych analizą obserwowano rosnącą liczbę chorych operowanych z powodu raka tarczycy. Jednocześnie w ostatnich latach obserwuje się coraz większą liczbą chorych operowanych we wczesnych stadiach choroby (guza o śr. do 1cm w latach 1994-96 nie stwierdzano w badanym materiale, w latach 1997-2000 stanowił 15%, a w latach 2001-03 już 34% wszystkich postaci). Klinicznie jawne przerzuty do węzłów chłonnych szyi stwierdzono u 8 pacjentów (8,4%) – tych chorych wykonano zmodyfikowaną limfadenektomię szyjną; przerzutów odległych nie stwierdzano.
Dyskusja
W związku z kluczową rolą zabiegu operacyjnego w skojarzonym leczeniu raka tarczycy, decyzja co do radykalności zabiegu jest podstawowym wyzwaniem chirurga. Dzieje się tak, gdyż właśnie radykalny zabieg ma największy wpływ na odległe wyniki leczenia, a skuteczność leczenia uzupełniającego jest w dużej mierze zależna od doszczętności wycięcia gruczołu [7,8].
Pomimo rozwoju przedoperacyjnej diagnostyki cytologicznej, w Polsce nadal w dużej liczbie przypadków rozpoznanie stawiane jest po zabiegu. Przyjęcie standardu postępowania w postaci radykalnego zabiegu chirurgicznego po jednej stronie umożliwia chirurgowi właściwe zaopatrzenie gruczołu w przypadku braku rozpoznania raka przed zabiegiem. W tej sytuacji wydaje się kluczowym doszczętne wycięcie gruczołu po jednej stronie z cieśnią oraz subtotalne wycięcie płata przeciwnego. W razie rozpoznania raka, z jednej strony daje to zadowalający efekt w przypadku stadiów mało zaawansowanych (mikrorak), z drugiej, w razie konieczności radykalizacji – pozwala na bezpieczny ponowny zabieg; zabieg, który ograniczony jest jedynie do jednej strony.
Uzupełniająca tyroidektomia zalecana jest w okresie do 5-6 dni lub około 3 miesiące po zabiegu pierwotnym [8]. W naszej praktyce zabiegi radykalizacyjne wykonywane były w okresie 6-12 tygodni po pierwszej operacji. W naszym materiale w 1 przypadku dużych wątpliwości, po szybkiej konsultacji z patologiem, dokonano radykalizacji w 5 dobie po pierwszym zabiegu. Warunki anatomiczne były porównywalne z zabiegiem pierwotnym. W prowadzeniu tzw. szybkich tyroidektomii uzupełniających (4-6 doba) mogą brać udział jednostki wyspecjalizowane, dysponujące odpowiednim sprzętem i zapleczem organizacyjnym.
Chorzy, u których rozpoznano raka tarczycy po zabiegu wycięcia wola wymagają szczególnej opieki. Często pogodzenie się z chorobą, a także koniecznością kontynuacji leczenia radioizotopowego jest dla nich wielkim wyzwaniem.
Podkreślane jest powszechnie indywidualizowanie podejścia do chorych z rakiem tarczycy. Obserwacja kliniczna pozwoliła na wyodrębnienie grup chorych o różnym rokowaniu w zależności od zaawansowania procesu chorobowego. Znalazło to odzwierciedlenie w utworzeniu wielu skal, np. AMES, AGES, MACIS, a także w klasyfikacji TNM [9]. Okazuje się, że młody wiek, mały rozmiar guza, zróżnicowana postać i niskie zaawansowanie histologiczne pozwalają na skuteczne leczenie raka tarczycy, które daje bardzo dobre rezultaty w postaci wysokich odsetków przeżyć i rzadkich wznów miejscowych.
Stąd też nadal trwa dyskusja na temat zakresu zabiegu pierwotnego [10,11], czy też konieczności wykonywania elektywnej linfadenektomii. Nie tylko zaawansowanie procesu chorobowego, ale i jakość wykonanego zabiegu składają się na całkowity efekt w postaci wyleczenia i dobrej jakości życia [12].
Piśmiennictwo
- Szawłowski A.W., Szmidt J. (Red.): Zasady diagnostyki i chirurgicznego leczenia nowotworów w Polsce. Wyd.: Fundacja Polski Przegląd Chirurgiczny, Warszawa 2003;
- Krzakowski M. (Red.): Zalecenia postępowania diagnostyczno-terapeutycznego w nowotworach złośliwych u dorosłych, Wyd.: Polska Unia Onkologii, Warszawa 2003;
- Gembicki M., Jarząb B., Królicki L., Kulig A., Kułakowski A., Lewiński A., Maciejewski B., Nauman J., Skrzypek J., Sowiński J., Steffen J., Szybiński Z., Wieczorek M.: Rozpoznawanie i leczenie raka tarczycy. Rekomendacje Komitetu Naukowego Sympozjum „Rak tarczycy”. Nowotwory 1996;46:248-56;
- Rekomendacje Komitetu Naukowego II Konferencji Naukowej „Rak tarczycy 2000”. Diagnostyka i leczenie nowotworów tarczycy. Wiadomości Lekarskie 2001;54 (suppl.1): 443-61;
- Łukieńczuk T., Dawiskiba J., Rychlewski D., Balcerzak W., Wojtczak B.: Rak tarczycy – postępy w diagnostyce oraz taktyce i technice chirurgicznej w okresie ostatnich 10 lat. Chirurgia Polska 2003;5:155-63;
- Szybiński Z., Szot W., Bobrowski A., Nowak K., Huszno B., Popiela T., Chłap Z.: Wartość diagnostyczna biopsji cienkoigłowej tarczycy we wczesnym rozpoznawaniu nowotworów złośliwych gruczołu tarczowego. Endokrynologia Polska 1987;38(suppl. 1):158.
- Pomorski L., Rybiński K., Narębski J.M., Stróżyk G.: Neoplasma folliculare – jako problem diagnostyczny i chirurgiczny. Polski Przegląd Chirurgiczny 1995;67: 786-91;
- Jamski J., Barczyński M., Cichoń S.: Taktyka i technika operacyjna w raku tarczycy. Polski Przegląd Chirurgiczny 2002;74:61-71;
- Bellantone R., Lombardi C.P., Bossola M., Boscherini M., De-Crea C., Alesina P., Traini E., Princi P., Raffaelli M.: Total Thyroidectomy for Management of Benign Thyroid Disease: Review of 526 Cases. World Journal of Surgery 2002;26:1468-71;
- D’Avanzo A., Ituarte P., Treseler P. et al. Prognostic Scoring Systems in Patients with Follicular Thyroid Cancer: A Comparison of Different Staging Systems in Predicting the Patient Outcome. Thyroid 2004;14:453-58;
- Hay I.D., Grant C.S., Taylor W.F., McConahey W.M.: Ipsilateral lobectomy versus bilateral lobar resection in papillary thyroid carcinoma: a retrospective analysis of surgical outcome using a novel prognostic scoring system. Surgery 1987;102:1088-95;
- Pasieka J.L.: The Surgeon as a prognostic factor in endocrine surgical diseases, Surgical Oncology Clinics of North America 2000;9:13–20.