Śluzak rzekomy otrzewnej – wskazanie do cytoredukcji i dootrzewnowej chemioterapii perfuzyjnej w hipertermii
Wstęp
Śluzak rzekomy otrzewnej [ŚRO] jest rzadko występującym nowotworem. Ocenia się, że dotyczy on 1osoby na milion [1]. Częściej występuje u kobiet [2,3] chociaż nie wszystkie doniesienia to potwierdzają [4]. Wywodzi się najczęściej z wyrostka robaczkowego, ale punktem wyjścia może też być inna część jelita grubego, jajnik, pęcherz moczowy i pęcherzyk żółciowy. Powstaje najczęściej z guzów produkujących śluz [cystadenoma mucinosum], tworzących torbiel śluzowe (mucocoele) lub raków śluzotwórczych (cystadenocarcinoma mucinosus) [1,5]. Jeśli proces śluzowacenia rozprzestrzenia się na całą jamę brzuszną to jest to cecha towarzysząca rakowi (pseudomyxoma peritonei) [6]. Jest to zazwyczaj nowotwór o niewielkim stopniu złośliwości, rosnący wolno i wydzielający śluz do jamy otrzewnej.
Wyróżnia się 3 typy ŚRO według klasyfikacji zaproponowanej przez Ronnetta: rozsiana śluzakowatość gruczołowa otrzewnej (DPAM – Disseminated Peritoneal Adenomucinosis), śluzakowatość rakowa otrzewnej (PMCA – Peritoneal Mucinous Carcinomatosis) oraz postać mieszana. Przypadki klasyfikowane jako DPAM charakteryzują się zmianami w otrzewnej utworzonymi z obfitego pozakomórkowego śluzu zawierającego niewielkie ogniska proliferującego nabłonka śluzotwórczego z atypią niewielkiego stopnia lub nieznaczną aktywnością mitotyczną. Zmiany PMCA charakteryzują się większą ilością nabłonka śluzotwórczego z przebudową i zmianami cytologicznymi charakterystycznymi dla raka z obecnością lub bez ognisk pierwotnego śluzotwórczego raka gruczołowego [7].
Samino-Mora i wsp. zwrócili uwagę na obecność szczepu bakterii Helicobacter pylori, która jest w stanie wywierć wpływ na ekspresję genu MUC2 i MUC5AC, w śluzie pobranym z jamy otrzewnej w przypadku śluzaka rzekomego otrzewnej. Ilość bakterii i ekspresji genu MUC2 była większa w przypadku śluzakowatości rakowej otrzewnej [PMCA] aniżeli w śluzowatości gruczołowej otrzewnej (DPAM). Autorzy zwracają uwagę na obecność bakterii H.pylori w postaciach bardziej złośliwych śluzaka i sugerują jej rolę w procesie carcinogenezy tego nowotworu [22].
Objawy i rozpoznanie kliniczne
Jednym z pierwszych objawów zauważalnych przez chorego jest powiększenie obwodu brzucha. Objaw ten występuje około 50% chorych ze śluzakiem rzekomym otrzewnej [21]. Często jest związany z charakterystycznym wyglądem brzucha, który wygląda jak zbiornik galarety (ang. „jelly belly”) oraz występującymi zaparciami związanymi rozwijającym się guzem i uciskiem jelit przez gromadzący się wewnątrzotrzewnowo śluz.
U niektórych chorych pierwszym objawem śluzaka są objawy związane z zapaleniem w okolicy wyrostka robaczkowego, co powoduje rozpoznanie appendicistis z następowym zabiegiem operacyjnym. Taka sytuacja występuje u około ¼ chorych. Rozpoznanie następuje po otwarciu jamy brzusznej, gdy chirurg stwierdza obecność obfitej treści śluzowej oraz w badaniu histopatologicznym pobranego materiału [3].
U kobiet, w około 1/3 przypadków, pierwszym objawem śluzaka może być obecność masy guzowatej w obrębie jajników. Rozpoznanie jest dokonywane w podobnej drodze jak w przypadku objawów zapalenia wyrostka robaczkowego.
Rozpoznanie śluzaka rzekomego otrzewnej jest często przypadkowe, gdy chirurg przeprowadza zabieg operacyjny z innego powodu, jak np. operacja przepukliny lub operacje ginekologiczne. Taka sytuacja dotyczy około 20% chorych ze śluzakiem [21].
Rozpoznanie histopatologiczne mas śluzowatych jest często pierwszym rozpoznaniem śluzaka rzekomego otrzewnej w sytuacji przypadkowego trafienia na obecność tego nowotworu. Do badań wykonywanych w przypadku powiększenia obwodu brzucha należą ultrasonografia i tomografia komputerowa. W badaniach tych stwierdzana jest obecność treści śluzowej, której gęstość różni się od gęstości wody (różnicowanie z wysiękiem nowotworowym) oraz obecność mas guzowatych.
Pozytronowa emisyjna tomografia 18F-FDG-PET nie wnosi dodatkowych informacji o rozległości choroby wewnątrz jamy otrzewnej, jednakże według Passot i wsp. ma znaczenie odnośnie możliwości wykonania cytoredukcji w trakcie zabiegu operacyjnego. Wykazali oni, że ujemny wynik badania współistnieje z ponad 80% zgodnością z możliwością wykonania zabiegu cytoredukcji. Odwrotna zależność – brak możliwości wykonania cytoredukcji guza w przypadku dodatniego wyniku badania PET nie zostało potwierdzone ze względu na niską czułość badania w tym zakresie [24].
W diagnostyce ŚRO stosuje się ocenę markerów, takich jak CEA, CA19-9, Ca 125, CK-20 (cytokeratyna 20). Spośród nich jedynie Ca 19-9 ma wartość rokowniczą [25].
Dootrzewnowa chemioterapia perfuzyjna w hipertermii – technika zabiegu
Po wykonaniu zabiegu wycięcia masy guza oceniamy pozostałość nowotworu w obrębie jamy otrzewnej za pomocą skali doszczętności cytoredukcji (Tab.1) [8].
| Stopień (Score) | Stopień cytoredukcji | Obraz makroskopowy |
|---|---|---|
| CC-0 | Całkowita cytoredukcja | Brak pozostałości nowotworu |
| CC-1 | Cytoredukcja kompletna | Guzki < 0,25 cm |
| CC-2 | Cytoredukcja niekompletna, pozostałość tkanki nowotworowej w stopniu średnim | Guzki > 0,25 cm ale < 2,5 cm |
| CC-3 | Cytoredukcja niekompletna, duża pozostałość tkanki nowotworowej | Guzki > 2,5 cm |
Zabieg dootrzewnowej chemioterapii perfuzyjnej w hipertermii [DCPH] jest wykonywany po cytoredukcji masy nowotworu ale przed chirurgicznym przywróceniem ciągłości przewodu pokarmowego [przed wykonaniem zespoleń w obrębie przewodu pokarmowego] [9]. Schemat procedury przedstawiono na Ryc.1.
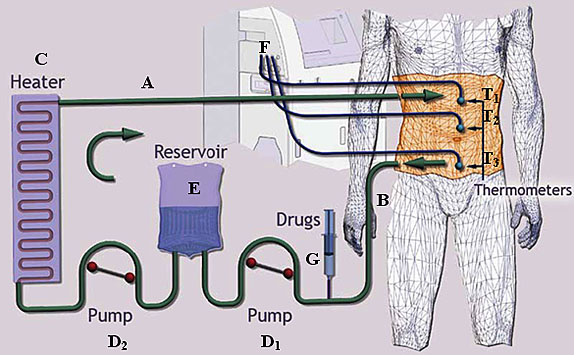
Ryc.1 Dootrzewnowa chemioterapia perfuzyjna w hipertermii – schemat procedury
(Ryc. za pozwoleniem RanD Corp., Modena, Italy)
Do jamy otrzewnowej pod łukami żebrowymi wprowadza się dwa dreny doprowadzające płyn [A] zaś w dolnej części tułowia wyprowadzone są dwa dreny odprowadzające [B]. Ogrzany w wymienniku ciepła do temperatury 430C [C] płyn jest wprowadzany do jamy otrzewnej. Temperatura płynu mierzona w jamie brzusznej powinna wynosić 41-420C. Drenami wyprowadzającymi płyn z jamy otrzewnej jest przepompowywany [D1] do zbiornika [E], który służy do wyrównywania różnic pomiędzy częścią płynu w jamie otrzewnej a częścią pozaotrzewnową. Stąd, za pomocą następnej pompy [D2] jest przenoszony do wymiennika ciepła [C]. Zintegrowany system pomiaru temperatury [F] czuwa z jednej strony nad zapewnieniem odpowiedniej wysokości temperatury płynu używanego do perfuzji, zaś z drugiej strony zapewnia bezpieczeństwo chorego, kontrolując temperaturę płynu wpływającego i wypływającego z jamy otrzewnej a także temperatury wewnątrz samej jamy otrzewnej [T1, T2, T3]
Po uzyskaniu odpowiedniej temperatury do drenu podawany jest lek przeciwnowotworowy, który ulega rozmieszaniu w płynie używanym do perfuzji i następnie podawany w sposób ciągły dootrzewnowo. Czas krążenia cytostatyku wynosi, w zależności od jego okresu półtrwania, od 60 do 90 minut, aczkolwiek niektórzy wykonują perfuzję w czasie 120 minut [9]. Następnie jest on wypłukiwany poprzez podanie i odebranie z jamy otrzewnowej dodatkowej ilości płynu, zazwyczaj około 3 litrów.
Płyn perfuzyjny
Do zabiegu DCPH używamy zazwyczaj płynu Ringera [10-13], płynu do dializy otrzewnowej [9,14-17] lub roztworu soli fizjologicznej [18]. Objętość płynu wynosi 3-4 L, w zależności od metody DCPH (przy metodzie otwartej - technika Coloseum) wymagana jest większa objętość płynu aniżeli w metodzie zamkniętej.
Leki przeciwnowotworowe
W leczeniu śluzaka rzekomego otrzewnej za pomocą zabiegu DCPH najczęściej używanym cytostatykiem jest mitomycyna C i cisplatyna i 5-fluorouracyl. Mitomycyna C stosowana w monoterapii jest podawana w dawce 10-35 mg/m2 [9, 19]
W skojarzeniu z cisplatyną podawaną w dawce 25 mg/m2/L mitomycyna C jest stosowana w ilości 3,3 mg/m2/L płynu perfuzyjnego [20]. Cioppa podaje dawkowanie tych leków w przeliczeniu na powierzchnię masy ciała. I tak cisplatyna podawana była w dawce 100 mg/m2, zaś mitomycyna C w dawce 16 mg/m2 [3]. Z kolei w schemacie z 5-fluorouracylem [650 mg/m2] mitomycyna C podawana jest w dawce 10-12,5 mg/m2 [19].
W przypadku mitomycyny C wskazane jest zmniejszenie dawki leku z 10 mg/L płynu perfuzyjnego w sytuacjach gdy: chory otrzymał wcześniej co najmniej 2 kursy chemioterapii, poziom kreatyniny w surowicy krwi jest wyższy niż 1.2 mg/dL, powierzchnia ciała jest mniejsza aniżeli 1,5 m2, chory ma więcej niż 65 lat. W przypadku, gdy zaistnieje jedno z wymienionych wskazań, dawkę mitomycyny C redukuje się o 33% (20 mg/chorego), zaś gdy wskazań do redukcji jest więcej niż jedno, dawka powinna być ograniczona o 50% (do 15 na/chorego) [9].
Szeroko stosowaną alternatywą w leczeniu śluzaka rzekomego otrzewnej jest zastosowanie, po zabiegu HIPEC, dootrzewnowej chemioterapii okołooperacyjnej w 1-5 dniu po zabiegu. Najczęściej stosowanym lekiem jest w tym przypadku %-Fluorouracyl, w dawce 650 mg./m2. Podanie chemioterapii dootrzewnowo jest uzasadnione szeroką dostępnością leków przeciwnowotworowych w okresie, gdy nie ma jeszcze zrostów włóknistych, które mogłyby ograniczyć przestrzeń dystrybucji cytostatyków. Jednak ze względu na znacząco większa ilość powikłań związanych z tym sposobem leczenia (większa ilość nieszczelności w obrębie zespoleń) oraz niepewna wartość terapeutyczną w porównaniu z samym zabiegiem HIPEC w ostatnim czasie zaproponowano badania randomizowane porównujące wartość leczenia za pomocą HIPEC w porównaniu z HIPEC + dootrzewnowa chemioterapia okołooperacyjna [19].
Wyniki leczenia
Rokowanie w śluzaku rzekomym otrzewnej jest uzależniony od kilku czynników. Pierwszym podstawowym czynnikiem jest rodzaj histopatologiczny śluzaka [2]. Ogółem 5-letnie przeżycie w tej chorobie po leczeniu chirurgicznym i HIPEC wynosi 54%-96% %, zaś 5-letni okres wolny od wznowy uzyskano u 37%-43% [2,4,19,25]. W przypadku rozsianej śluzakowatości gruczołowej otrzewnej [DPAM] rokowanie jest lepsze aniżeli w śluzakowatości rakowej otrzewnej [PMCA]. 3-letnie przeżycie po zabiegu cytoredukcji i dootrzewnowej chemioterapii perfuzyjnej w hipertermii wynosi odpowiednio 85% i 41% [2, 23]. Różnica w przebiegu klinicznym i przeżywalności pomiędzy DPAM i PMCA zwróciła uwagę Chua i wsp., którzy zaproponowali badanie kliniczne różnicujące sposób leczenia chorych, w oparciu o cytoredukcję i dootrzewnową chemioterapię perfuzyjną. U chorych z DPAM proponują oni po zakończeniu leczenia miejscowego podanie chemioterapii systemowej FOLFOX [19].
Następnym, niezwykle istotnym czynnikiem wpływającym na wyniki lecenia śluzaka rzekomego otrzewnej jest całkowita cytoredukcja zmian nowotworowych przed wykonaniem zabiegu perfuzji dootrzewnowej. Ważne jest w tym przypadku wykonanie cytoredukcji poprzez wycięcie otrzewnej ze zmianami nowotworowymi a nie samo wycięcie zmian nowotworowych z otrzewnej [3,23]. Zabiegi cytoredukcyjne u chorych ze śluzakiem rzekomym otrzewnej są czasochłonne [średni czas trwania zabiegu cytoredukcji – około 6 godzin] oraz obarczone około 27% - 40% ilością powikłań okołooperacyjnych, głównie związanych z nieszczelnością zespoleń i neutropenią po chemioterapii dootrzewnowej [3, 17, 23]. Jednak całkowita cytoredukcja zmian nowotworowych jest zasadniczym elementem wpływającym na rokowanie co do wleczenia i okresu bez objawów wznowy. Przeżycie 5-letnie po wykonaniu całkowitej cytoredukcji [CC-0] śluzaka rzekomego otrzewnej i wykonaniu dootrzewnowej chemioterapii perfuzyjnej w hipertermii wynosi 75% - 97% [2, 3, 4, 19, 23, 25]. Brak możliwości całkowitej cytoredukcji redukuje wyniki przeżyć 5-letnich do około 20% [23].
Okres wolny od wznowy po całkowitym usunięciu guza (CC-0) wynosi 43% - 80% [3, 25] i jest zależny od typu histopatologicznego śluzaka [23]. Podwyższony poziom antygenu CA 19-9 jest związany z krótszym okresem wolnym od wznowy nowotworu [25].
Wnioski
Nowoczesne leczenie śluzaka rzekomego otrzewnej, nowotworu niejednolitego pod względem histologicznym, polega na wykonaniu jak najszerszej cytoredukcji i zastosowaniu dootrzewnowej chemioterapii perfuzyjnej w hipertermii. Wyniki leczenia są lepsze w przypadku rozsianej śluzakowatości gruczołowej otrzewnej [DPAM] niż w śluzakowatości rakowej otrzewnej [PMCA], gdy jest możliwe wykonanie całkowitej cytoredukcji guza [CC-0]. W przypadku PMCA należy rozważyć bardziej agresywne sposoby leczenia włącznie z chemioterapią systemową ze względu na wciąż niezadowalające wyniki leczenia. Ocena poziomu CA 19-9 może pomóc w kwalifikacji chorych do bardziej szczegółowych i częstszych kontroli po zakończeniu leczenia chirurgicznego.
Piśmiennictwo
- Mukherjee A., Parvaiz A., Cecil T., Moran B.: Pseudomyxoma peritonei usually originates from the appendix: areview of the evidence. Eur J Gynaecol Oncol 2004;25:411-414;
- Smeenk R., Verwaal V., Antonini N., Zoetmulder F.: Survival analysis of pseudomyxoma peritonei patients treated by cytoreductive burgery and hyperthermic intraperitoneal chemotherapy. Ann Surg 2007;245:104-109;
- Cioppa T., Vaira M., Bing C., D'Amico S., Bruscino A., De Simone M.: Cytoreduction and hyperthermic intraperitoneal chemotherapy in the treatment of peritoneal carcinomatosis from pseudomyxoma peritonei. World J Gastroenterology 2008;14:6817-6823;
- Deraco M., Baratti D., Inglese M., Allaria B., Andreola S., Gavazzi C., Kasamura S.: Peritonectomy and intraperitoneal hyperthermic perfusion (IPHP): a strategy that has confirmed its efficacy in patients with pseudomyxoma peritonei. Ann Surg Oncol 2004;11:393-398;
- Hinson F., Ambrose N.: Pseudomyxoma peritonei. Br J Surg 1998;85:1332-1339;
- Nowotwory. Zarys patologii klinicznej. Red. Kordek R., Woźniak L., Biernat W. Wyd.Akad.Med.Łódź, Łódź 2001:91;
- Ronnett B., Zan C., Kurman R., Kurman J., Kass E., Sugarbaker P., Shmookler B.: Disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis. A clinicopathologic analysis of 109 cases with emphasis on distinguishing pathologic features, site of origin, prognosis, and relationship to “pseudomyxoma peritonei”. Am J Surg Pathol 1995;19:1390-1408;
- Jacquet P., Sugarbaker P.: Current methodologies for clinical assessment of patients with peritoneal carcinomatosis. I Exp Clin Cancer Res 1996;15:49-58;
- Jacquet P., Stephens A., Averbach A., Chang D., Ettinghausen S., Dalton R., Steves M., Sugarbaker P.: Analysis of morbidity and mortality in 60 patients with peritoneal carcinomatosis treated by cytoreductive surgery and heated intraoperative intraperitoneal chemotherapy. Cancer 1996;77:2622-2629;
- Elias D., Blot F., El Otmany A., Antoun S., Lasser P., Boige V., Rougier P., Ducreux M.: Curative treatment of peritoneal carcinomatosis arising from colorectal cancer by complete resection and intraperitoneal chemotherapy. Cancer 2001;92:71-76;
- Samel S., Singal A., Becker H., Post S.: Problems with intraoperative hyperthermic peritoneal chemotherapy for advanced gastric cancer.Eur J Surg Oncol 2000;26:222-226;
- Shen P., Hawksworth J., Lovato J., Loggie B., Geisinger K., Fleming R., Levine E.: Cytoreductive surgery and intraperitoneal hyperthermic chemotherapy with mitomycin C for peritoneal carcinomatosis from nonappendiceal colorectal carcinoma. Ann Surg Oncol 2004;11:178-186;
- Loggie Fleming R., McQuellon R., Russell G., Geisinger K.: Cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for disseminated peritoneal cancer of gastrointestinal origin. Am Surg 2000;66:561-568;
- Glehen Mithieux F., Osinsky D., Beaujard AC., Freyer G., Guertsch P., Francois Y., Peyrat P., Panteix G., Vignal J., Gilly FN.: Surgery combined with peritonectomy procedures and intraperitoneal chemohyperthermia in abdominal cancers with peritoneal carcinomatosis: a phase II study. J Clin Oncol 2003;21:799-806;
- Knorr C., Reingruber B., Meyer T., Hohenberger W., Stremmel C.: Peritoneal carcinomatosis of colorectal cancer: incidence, prognosis, and treatment modalities. Int J Colorectal Dis 2004;19:181-187;
- Kim J-Y., Bae H.: A controlled clinical study of serosa-invasive gastric carcinoma patients who underwent surgery plus intraperitoneal hyperthermo-chemo-perfusion (IHCP).Gastric Cancer 2001;4:27-33;
- Witkamp A., de Bree E., Kaag M., Boot H., Beijnen J., van Slooten G., van Coevorden F., Zoetmulder F.: Extensive cytoreductive surgery followed by intra-operative hyperthermic intraperitoneal chemotherapy with mitomycin-C in patients with peritoneal carcinomatosis of colorectal origin.: Eur J Cancer 2001;37:979-984;
- Shido A., Ohmura S., Yamamoto K., Kobayashi T., Fujimura T., Yonemura Y.: Does hyperthermia induce peritoneal damage in continuous hyperthermic peritoneal perfusion? World J Surg 2000;24:507-511;
- Chua T., Al-Mohaimed K., Liauw W., Morris L..: Pseudomyxoma peritonei: a need to establish evidence-based standard of care-is this the right trial ? Ann Surg Oncol 2009;16:2675-2677;
- Kusamura S., Younan R., Baratti D., Costanzo P., Favaro M., Gavazzi C., Deraco M.: Cytoreductive surgery followd by intraperitoneal hyperthermic perfusion. Cancer 2006;106:1144-1153;
- Smeenk R., Verwaal V., Zoetmulder F.: Pseudomyxoma peritonei. Caner Treat Rev 2007;33:138-145;
- Samino-Mora C., Liu H., Nieroba C., Studeman K., Sardi A., Dubois A.: Pseudomyxoma peritonei: is disease progression related to microbial agents ? A study of bcteria, MUC2 and MUC5AC expression in disseminated peritoneal adenomucinosis and peritoneal mucinous carcinomatosis. Ann Surg Oncol 2008;15:1414-1423;
- Sugarbaker P.: Cytoreductive burgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome. Eur J Surg Oncol 2001;27:239-243;
- Passot G., Glehen O., Pellet O., Isaac S., Tychy C., Mohammed F., Giamarile F., Gilly F., Cotte E.: Pseudomyxoma peritonei: role of 18F-FDG PET in preoperative evaluation of pathological grade and potential for complete cytoreduction. Eur J Surg Oncol 2010;36:315-323;
- Baratti D., Kusamura S., Nonaka D., Langer M., Andreola S., Favro M., Gavazzi C., Laterza B., Deraco M.: Pseudomyxoma peritonei: clinical pathological and biological prognostic factors in patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Ann Surg Oncol 2008;15:526-534;